L’autophagie est un mécanisme cellulaire conservé chez tous les eucaryotes qui consiste en la dégradation de composants cytoplasmiques de la cellule par ses propres lysosomes. Décrite à l’origine comme un processus catabolique non spécifique activé par la carence en nutriments, l’autophagie est maintenant connue pour assurer la dégradation de substrats spécifiques comme les mitochondries endommagées, certaines bactéries intracellulaires ou des agrégats protéiques. Ce processus joue de ce fait un rôle important dans la réponse immunitaire ainsi que dans certaines pathologies neurodégénératives et dans le maintien de l’homéostasie cellulaire. Plusieurs niveaux de régulation de l’autophagie impliquent une réaction dite d’ubiquitination qui contrôle la stabilité de régulateurs de l’autophagie et agit comme un signal permettant le ciblage de substrats spécifiques vers les autophagosomes.Nous utilisons la drosophile comme modèle d’étude des mécanismes de contrôle de la réponse inflammatoire ou immunitaire innée par les protéases d’ubiquitine (ou
déubiquitinases). Nous cherchons également à déterminer le rôle des déubiquitinases dans le processus d’autophagie. Pour cela, nous avons réalisé un crible génétique
in vivo chez la drosophile qui nous a permis d’identifier plusieurs déubiquitinases qui régulent négativement l’autophagie. L’une d’entre elles, UBPY, a été plus particulièrement étudiée. Alors que cette déubiquitinase avait jusqu’à maintenant surtout été décrite pour son rôle dans l’
endocytose, nous avons montré que son inactivation provoque l’accumulation d’autophagosomes ; cette accumulation est liée à un blocage dans leur dégradation due à une altération de la morphologie et de la fonction des lysosomes.
Ces résultats indiquent que la protéase UBPY est requise pour la biogenèse et/ou la maintenance des lysosomes. Ils ouvrent par ailleurs la question de savoir si les défauts lysosomaux induits par l’inactivation de UBPY sont une conséquence de son rôle dans l’endocytose ou s’ils mettent en évidence une nouvelle fonction de cette déubiquitinase.
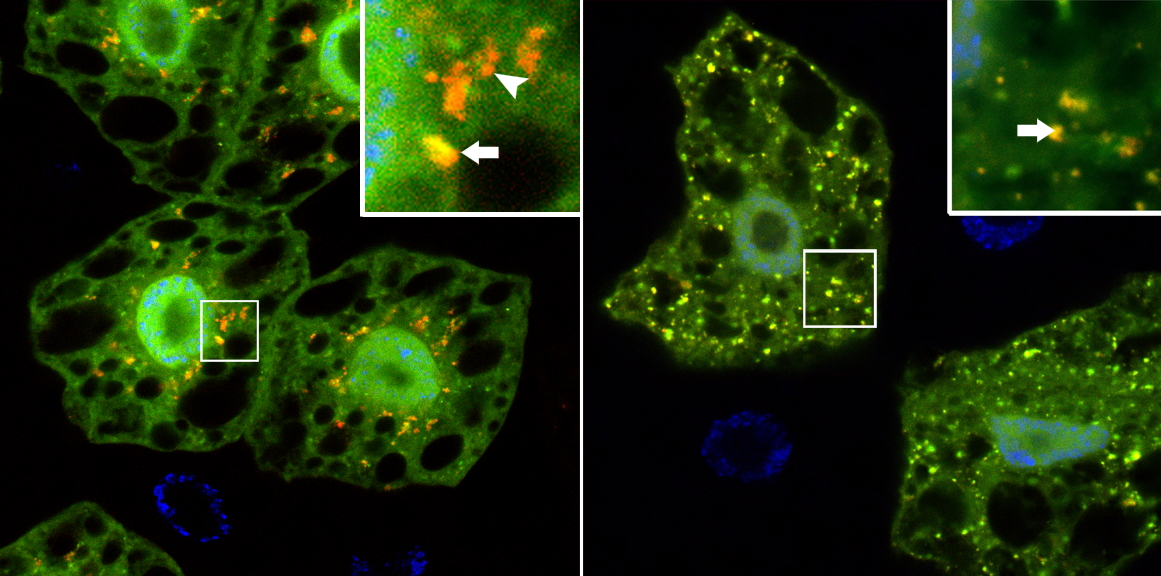
Dans des cellules normales (à gauche) où l’autophagie a été induite en privant de nourriture les larves de Drosophile pendant 4 heures, on observe des autophagosomes (jaune) et des autolysosomes (rouge) résultant de la fusion des autophagosomes avec les lysosomes. À droite, dans des cellules ou l’expression de UBPY a été réduite par RNAi, on observe des autophagosomes (jaune) mais aucun autolysosome.
Les
lysosomes sont des organites intracellulaire ayant une fonction de « poubelle cellulaire », où les molécules non fonctionnelles sont éliminées par digestion.
Déubiquitinases : enzymes qui retirent des monomères ou des polymères d’ubiquitine des protéines ubiquitinées.
L'ubiquitine étant une protéine de 76 acides aminées très conservée dans le monde du vivant et qui, en se liant aux protéines, modifie leur stabilité ou leur activité.
L’endocytose est un processus qui permet l’entrée dans la cellule d’éléments du milieu extracellulaire et de constituants de la membrane plasmique dans des vésicules dérivées de la membrane.