 Caractérisation des cibles d’UPS dans le cancer
Caractérisation des cibles d’UPS dans le cancer
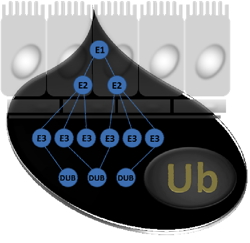
Le système ubiquitine-protéasome (UPS) a émergé comme une cible prometteuse pour le traitement du cancer. L'UPS régule la dégradation par le protéasome de la plupart des protéines cellulaires
via l’attachement covalent d’une petite protéine, l’ubiquitine. De manière notable, l’inhibition de l’UPS induit l'apoptose dans les cellules cancéreuses de la prostate. Ainsi, le défi majeur dans le développement de médicaments est d'identifier quels composants de l’UPS sont spécifiquement requis pour la survie des cellules cancéreuses. Nous avons utilisé des cribles ARNi pour identifier plusieurs gènes de l’UPS potentiellement intéressants. La déplétion de ces gènes induit l’inhibition de la prolifération et l'apoptose des cellules cancéreuses prostatiques. Nos meilleurs gènes-candidats codent pour des protéines largement non-caractérisées. Bien que la présence des motifs caractéristiques permette de les classer dans des familles spécifiques de protéines, aucune activité enzymatique ou fonction biologique de ces protéines n’a été décrite. L'objectif de cette thèse est de caractériser l'activité biochimique et les fonctions cellulaires des protéines de l’UPS identifiées, ainsi que de définir leurs partenaires et substrats potentiels.
Rulina AV, Mittler F, Obeid P, Gerbaud S, Guyon L, Sulpice E, Kermarrec F, Assard N, Dolega ME, Gidrol X and Balakirev MY
Distinct outcomes of CRL-Nedd8 pathway inhibition reveal cancer cell plasticity.
Cell Death and Disease, 2016,
7(12): Article number e2505
 Nouvelles protéases impliquées dans la réparation de l’ADN
Nouvelles protéases impliquées dans la réparation de l’ADN
L'ADN est la molécule centrale de la vie. Chaque jour, l’ADN subit des milliers de lésions, ce qui peut compromettre l'intégrité de l'information génétique qu’il contient. La réparation des complexes anormaux et des cross-links covalentes ADN-protéines (DNA–protein crosslinks, DPC) est particulièrement difficile. Les données récentes suggèrent que les enzymes protéolytiques aident les nucléases à réparer les DPCs en dégradant le composant protéique des cross-links. Récemment, de nouvelles métallo-protéases ont été découvertes, qui dégradent les protéines problématiques sur la chromatine. Ce mécanisme semble avoir être conservé au cours de l'évolution. Le but de ce projet est de caractériser biochimiquement et structurellement ces nouvelles enzymes impliquées dans la réparation des dommages de l'ADN.

Balakirev MY, Mullally JE, Favier A, Assard N, Sulpice E, Lindsey DF, Rulina AV, Gidrol X and Wilkinson KD
Wss1 metalloprotease partners with Cdc48/Doa1 in processing genotoxic SUMO conjugates.
eLife, 2015,
4(September2015): number e06763>
Pour une liste exhaustive voir
Publications