On ne compte plus les molécules, candidats médicaments, qui promises à un bel avenir après des essais sur des cellules humaines cultivées en deux dimensions (2D) dans des boîtes de pétri, se sont finalement avérées inefficaces, voire même toxiques, une fois testées sur les animaux ou en clinique. Une des raisons pourrait être qu’à la différence des boîtes de pétri, « nous ne sommes pas plan ». Afin de mieux comprendre les grandes fonctions biologiques et physiologiques humaines, mais aussi de diminuer le taux d’attrition des médicaments, il est nécessaire d’optimiser les modèles d’études pour l’humain utilisés par les biologistes d’une part et l’industrie pharmaceutique d’autre part. Les cellules au sein d’un tissu sont soumises à un mélange complexe de contraintes (signaux, stimuli…). Or, bien que la culture de cellules humaines en 2D ait permis des avancées majeures, elle modélise mal la réalité du microenvironnement cellulaire dans un tissu. Cultivées en 2D, les cellules prolifèrent sur un substrat rigide. Les facteurs de croissance et l’oxygène sont présents à des concentrations anormalement élevées. Les interactions cellules-cellules, lorsqu’elles existent, sont totalement désorganisées et parce que les cellules poussent dans un plan, les signaux 3D sont absents. Ces limitations altèrent donc notre compréhension du vivant et réduisent leur pertinence et leur potentiel applicatif. La biologie humaine entre dans une nouvelle ère où les biologistes cultivent des cellules en 3D pour se rapprocher de la réalité physiologique. Ainsi les modèles
ex vivo d’architecture 3D ont le potentiel de combler le manque existant entre la culture conventionnelle en 2D et l’expérimentation animale.
Les acini sont des structures en grappes correspondant aux terminaisons des glandes exocrines où sont produites les sécrétions. Les modèles d’étude favoris de notre laboratoire sont les sphéroïdes et les acini de prostate (
Figure). Nous utilisons le potentiel de la microfluidique pour générer de manière aussi automatisée et reproductible que possible des structures cellulaires en 3D dans des micro-billes mono-dispersées de polymère. Ces micro-billes permettent de systématiser et de contrôler l’obtention d’édifices cellulaires 3D de tailles et de formes constantes. Il devient donc envisageable d’automatiser la fabrication et l’analyse de ces objets biologiques et d’ouvrir ainsi de nouvelles perspectives d’applications, comme par exemple des études temporelles en biochimie, en génétique et en génomique pour l’analyse exhaustive du développement acinaire.
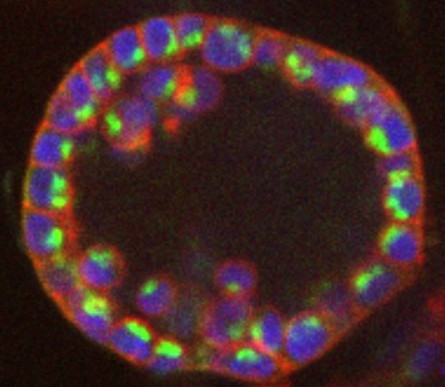
Formation d’un acinus de prostate en culture 3D. En bleu : noyau. En vert : appareil de golgi. En rouge : F-actine.
© S. Porte, Biomics
La culture de cellules humaines dans des modèles
ex vivo en 3D devrait impacter notre compréhension du vivant tant au plan fondamental, par exemple pour l’étude des cellules souches, de la plasticité cellulaire, de l’embryogenèse et du développement, qu’au plan appliqué dans le domaine de la cancérologie, des maladies infectieuses, etc. Mais elle permettra aussi de réaliser des cribles pharmacologiques et des tests de toxicité dans des conditions plus proches de la réalité physiologique, tout en permettant de réduire le nombre de tests sur les animaux de laboratoire. Enfin, la culture de cellules humaines en 3D dans des microsystèmes ouvre un nouveau champ de recherche passionnant sur l’ingénierie tissulaire et la reconstitution de tissus, voire d’organes, sur puce et/ou par impression 3D.