L’oncogène c-Myc code pour un facteur de transcription qui contrôle l’expression de très nombreux gènes impliqués dans la croissance et la prolifération cellulaire. Il est surexprimé dans plus de 70 % des cancers humains, ce qui montre l'importance qu’il y a à contrôler précisément la quantité de protéine MYC présente dans les cellules. Chez l’Homme, et dans des organismes modèles tels que
Drosophila melanogaster, ce contrôle est assuré par la voie de dégradation des protéines qui passe par le système ubiquitine-protéasome. Cette voie de dégradation des protéines est caractérisée par deux événements séquentiels : le premier consiste en l’étiquetage des substrats destinés à être dégradés par un polymère de molécules d’ubiquitine via une ubiquitine ligase ; le second est la reconnaissance puis la dégradation de ces substrats poly-ubiquitinés par un complexe enzymatique multiprotéique, le protéasome. Les déubiquitinases qui catalysent l’élimination des polymères d’ubiquitine peuvent contrer cette dégradation et stabiliser la protéine ciblée. Si les ubiquitine ligases impliquées dans la régulation de MYC par le système ubiquitine-protéasome sont bien connues, les déubiquitinases le sont beaucoup moins.
Nous montrons que l'homologue chez la drosophile de la déubiquitinase USP36 humaine possède différentes isoformes qui ont chacune des localisations subcellulaires spécifiques. En utilisant la mutagenèse CRISPR-Cas9 pour introduire des mutations dans le gène codant pour USP36, nous identifions l'une des isoformes comme étant spécifiquement requise pour le développement des stades larvaires et la croissance des cellules au sein de l’organisme entier (
Figure).
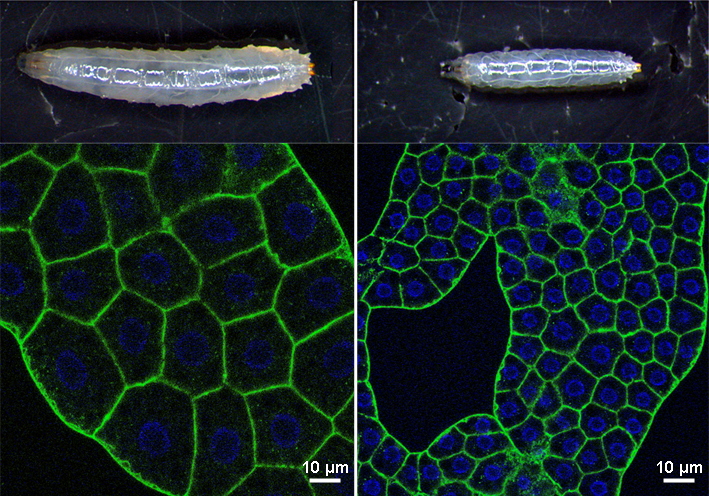 En haut et à gauche, on peut voir une larve de drosophile normale et dessous, une image prise au microscope confocal de cellules du corps gras larvaire (les contours cellulaires sont marqués en vert et les noyaux en bleu). En haut et à droite, on observe une larve du même âge chez laquelle une des isoformes d’USP36 a été inactivée. Les défauts de croissance au niveau de l’organisme entier et des cellules du corps gras indiquent que cette isoforme joue un rôle dans ces processus.
En haut et à gauche, on peut voir une larve de drosophile normale et dessous, une image prise au microscope confocal de cellules du corps gras larvaire (les contours cellulaires sont marqués en vert et les noyaux en bleu). En haut et à droite, on observe une larve du même âge chez laquelle une des isoformes d’USP36 a été inactivée. Les défauts de croissance au niveau de l’organisme entier et des cellules du corps gras indiquent que cette isoforme joue un rôle dans ces processus.
Nous montrons que cette isoforme d’USP36 forme un complexe protéique comprenant non seulement la protéine MYC mais aussi l’ubiquitine ligase AGO. Dans un système de cellules de drosophile en culture, nous avons alors démontré que la ligase AGO contrôle l’ubiquitination et la dégradation de MYC tandis que la déubiquitinase USP36 induit l’effet inverse. Des expériences d’interactions génétiques menées
in vivo ont ensuite confirmé les rôles antagonistes de ces deux protéines sur la croissance cellulaire.
Ces résultats mettent donc en évidence l’existence d’un complexe protéique fonctionnel tripartite, composé de MYC, AGO et USP36 qui permet une régulation fine et dynamique de la quantité de protéine MYC dans le noyau au travers du contrôle de son niveau d’ubiquitination. Ce mécanisme de régulation est conservé au cours de l’évolution et participe directement aux processus de croissance et de prolifération cellulaire qui sont impliqués au cours du développement ou dans le cancer.