Nos cellules reçoivent et transmettent en permanence des signaux issus de cellules voisines ou de tissus spécialisés ce qui permet le développement harmonieux de l’organisme et le fonctionnement de nos différents organes tout au long de notre vie. Ces signaux sont par exemple des facteurs de différenciation, de croissance cellulaire ou des molécules inflammatoires qui sont captés par des récepteurs exprimés à la surface des cellules. Une fois lié à son ligand, le récepteur active une ou plusieurs voies de signalisation intracellulaire en cascade jusqu’à des effecteurs cytoplasmiques ou nucléaires qui induisent une réponse adaptée de la cellule. L’arrêt du signal passe très fréquemment par l’internalisation du récepteur par endocytose.
La liaison d’une molécule d’ubiquitine à un récepteur cellulaire constitue le signal moléculaire primordial qui induit son internalisation. En étant capable d'hydrolyser spécifiquement cette liaison, la protéase USP8 peut réguler le trafic, le tri et la stabilité de nombreux récepteurs membranaires à différents niveaux de la voie endocytaire.
Les travaux de chercheurs de notre laboratoire, menés en collaboration avec l’IBS, ont montré qu’une protéine du complexe endocytaire (CHMP1B) est ubiquitinée de façon dynamique dans les 5 à 10 minutes qui suivent une stimulation des cellules par l'EGF, un facteur de croissance cellulaire (Figure). Cette ubiquitination s'avère nécessaire pour la fonction de CHMP1B dans le trafic intracellulaire dans des cellules humaines en culture, ainsi que pour la morphogenèse de l’aile chez la drosophile. Les résultats obtenus montrent également que CHMP1B est une cible de l’enzyme USP8 qui, en déubiquitinant CHMP1B, pourrait favoriser sa polymérisation au niveau de la membrane des endosomes (Figure).
Des mécanismes similaires de régulation pourraient exister dans tous les autres processus nécessitant une déformation de la membrane cellulaire, à l'image de la cytokinèse (division cellulaire), du bourgeonnement viral ou de l’autophagie. C’est dire l’importance que revêt l'identification des cibles thérapeutiques qui contrôlent l’activité physiologique ou pathologique des protéines de la voie endocytaire.
Nous nous intéressons à poursuivre l’étude de la fonction d’USP8 et à sélectionner des inhibiteurs chimiques dans un contexte où des formes mutantes constitutivement actives sont exprimées dans des patients atteints de la maladie de Cushing.
*
L’ubiquitine est un petit polypeptide de 72 acides aminés très conservé au cours de l’évolution, exprimé de façon ubiquitaire dans les cellules et pouvant se lier à des protéines cibles
via une liaison covalente sur le groupement NH2 libre d’un résidu lysine. L’ubiquitine contenant des résidus lysines, elle peut polymériser en différents types de chaînes de polyubiquitine. Cette modification post-traductionnelle des protéines agit sur leur activité ou leur stabilité et peut aussi favoriser la formation de complexes protéiques.
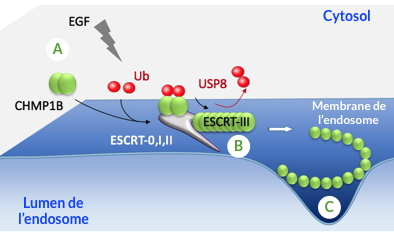
A - La protéine CHMP1B est ubiquitinée et recrutée au niveau de la membrane des endosomes après stimulation par l’EGF.
B - L’hydrolyse de l’ubiquitine par USP8 permettrait la polymérisation de CHMP1B et
C - la déformation de la membrane des endosomes.