L’autophagie, du grec « se manger soi-même », est un processus catabolique impliqué dans de nombreux aspects de la vie des organismes comme l’adaptation au stress, le vieillissement, l’immunité et le développement. Chez l’homme, les dysfonctionnements de ce processus sont associés au cancer, à des maladies inflammatoires ou à des pathologies neurodégénératives. Aujourd’hui, l’étude de l’autophagie est un domaine de recherche en pleine expansion puisque la stimulation de l’autophagie constitue une piste thérapeutique pour ces affections.
Initialement décrit comme un processus de dégradation non spécifique enclenché par la privation en nutriments, l’autophagie est également responsable de la dégradation de substrats spécifiques dont certains sont étiquetés par des
résidus d’ubiquitine. Sont ainsi dégradés par autophagie : les mitochondries sénescentes, certaines bactéries intracellulaires et des agrégats protéiques résistants à la dégradation par le protéasome. Les mécanismes responsables du ciblage de ces substrats spécifiques vers la voie autophagique restent très mal connus ainsi que leur régulation.
Nous nous intéressons au rôle de l’ubiquitination, et plus particulièrement à celui des déubiquitinases (enzymes éliminant des résidus d’ubiquitine) dans divers aspects de la réponse immunitaire innée. C’est dans ce cadre que nous avons identifié chez la drosophile la déubiquitinase USP36
[1] et montré son rôle dans la modulation de la signalisation intracellulaire gouvernant la réponse immunitaire et inflammatoire.
À partir de l’analyse du phénotype des mutants de délétion d'USP36 de drosophile, nous montrons dans cette nouvelle étude
[2] que l’inactivation de USP36 inhibe la croissance cellulaire et active l’autophagie (
Figure). L’autophagie ainsi induite dépend de la présence de la protéine p62, une protéine adaptatrice qui se lie aux substrats ubiquitinés et les cible vers les auto-phagosomes. En accord avec cette observation, les cellules mutantes pour USP36 accumulent des protéines ubiquitinées dans le noyau, ainsi que dans le cytoplasme où elles sont éliminées par autophagie. De façon intéressante, la fonction d’USP36 dans l’autophagie sélective est conservée dans les cellules humaines puisque l’inactivation du gène humain équivalent, entraîne une activation constitutive de l’autophagie de façon dépendante de p62. Ces travaux décrivent donc, pour la première fois, l’implication d’une déubiquitinase dans le contrôle de l’autophagie sélective de substrat ubiquitinés chez la drosophile ainsi que sur des modèles de cellules humaines en culture.
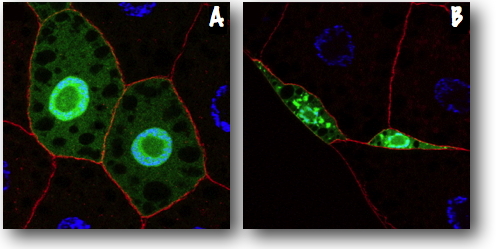
Images en microscopie confocale de cellules de corps gras larvaire dans lequel a été généré un clone de cellules sauvages (A) ou délétées d'USP36 (B) exprimant le rapporteur d’autophagie GFP-LC3.
Vert : GFP-LC3, Rouge : Phalloidine, Bleu : DAPI.
Une caractéristique commune à de nombreuses maladies neurodégénératives est l’accumulation de protéines mutées ou toxiques et leur agrégation dans le cytoplasme. Ces maladies (protéinopathies) comprennent notamment la maladie d’Huntington, la maladie d’Alzheimer ou la maladie de Machado-Joseph. L’origine de ces agrégats de protéines reste obscure. Il a été proposé qu’une diminution de l’activité du protéasome pourrait provoquer l’accumulation d'agrégats protéiques. Les données publiées par cette équipe montrent que l’inactivation d’une déubiquitinase telle que USP36 suffit à provoquer l’accumulation d'agrégats protéiques ubiquitinés et ouvrent donc de nouvelles pistes pour comprendre l’origine des protéinopathies.
L'ubiquitine est une protéine de 76 acides aminées très conservée dans le monde du vivant et qui, en se liant aux protéines, modifie leur stabilité ou leur activité.