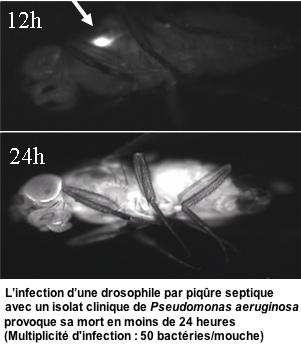
Certains facteurs de virulence de ce pathogène sont communs à d'autres bactéries à Gram-négatif, qui posent de graves problèmes de santé publique, et ciblent des mécanismes ancestraux de la réponse immunitaire innée conservés dans le monde vivant. Ceci permet d'utiliser des organismes génétiques simples, comme la mouche Drosophile, pour l'étude des interactions hôte-pathogènes en s'affranchissant des limitations éthiques et financières posées par l'expérimentation animale.
Les chercheurs de cette équipe avaient préalablement démontré l'importance du système de sécrétion de type III de la bactérie
P. aeruginosa dans l'induction d'une mort rapide des drosophiles et le rôle de la toxine ExoS dans l'inhibition de la réponse immunitaire cellulaire
in vivo [1, 2]. Le domaine GAP de la toxine Exos peut cibler l'ensemble des GTPases monomériques de la famille Rho impliquées dans la réorganisation du cytosquelette d'actine, et par voie de conséquence, dans le chimiotactisme des cellules au site d'infection et la phagocytose des pathogènes. Les derniers travaux obtenus par cette équipe
[3] montrent que ces GTPases sont requises de façon différentielle dans l'organisme infecté ; Rac2 ayant un rôle prépondérant dans la résistance à
P. aeruginosa. Rac2 est indispensable à l'internalisation des pathogènes par les phagocytes où il serait la cible privilégiée du domaine GAP de la toxine ExoS. Par contre, Rac2 n'est pas requis pour l'induction des voies de signalisation de la réponse immunitaire innée, Toll et Imd, dépendantes des facteurs NF-kappaB. La susceptibilité accrue des mouches Rac2-/- aux infections bactériennes illustre le rôle essentiel de l'immunité cellulaire dans la lutte contre les pathogènes.
Ces travaux ont été soutenus par la Région Rhône-Alpes (programme Emergence 2002).