Toute découverte biologique nécessite une validation sur un modèle expérimental, de préférence un organisme vivant. Or, il existe de nombreuses limitations pratiques, financières et éthiques à l’expérimentation sur des mammifères. La mouche du vinaigre, Drosophila melanogaster, est un organisme métazoaire qui dépend pour sa survie, son métabolisme, et son développement embryonnaire, de mécanismes fondamentaux très similaires à ceux des mammifères dont l’Homme. Sur ce modèle génétique simple, il est possible d’induire de multiples mutations et d’obtenir, à grande échelle, des organismes génétiquement modifiés. Plusieurs milliers de mouches peuvent alors être criblées afin de découvrir de nouveaux gènes impliqués dans un processus biologique donné. C’est l’approche génétique qui permet la découverte des fonctions des gènes. Par ailleurs, la connaissance du génome et la création de clones cellulaires permettant d’exprimer ou d’éteindre chacun des gènes de drosophile autorisent des approches haut débit de génomique fonctionnelle. Pour ces raisons, les drosophiles se prêtent à des études prospectives irréalisables sur des modèles mammifères. Ce constat a suscité l’ouverture, aux Etats-Unis, en Asie et en Europe (Heidelberg, Vienne), de centres dédiés à la création et la maintenance de lignées de drosophiles transgéniques, pour l’étude de chacun des 13 à 15 000 gènes identifiés dans son génome. Les connaissances établies chez la drosophile ont largement fait progresser notre compréhension du vivant et elles contribuent de plus en plus à des avancées dans différents domaines de la santé humaine, comme le cancer, la dégénérescence neuronale ou la réponse immunitaire innée
[1].
L’équipe dirigée par Marie-Odile Fauvarque a centré ses recherches sur l'étude des mécanismes de défenses naturelles aux infections par des micro-organismes pathogènes (réponse immunitaire innée). Ces chercheurs ont découvert de nouveaux acteurs de la lutte contre les pathogènes, agissant dans les cellules phagocytaires de la lignée sanguine
[2-4]. Leurs capacités anti-infectieuses vont pouvoir maintenant être étudiées en cellules humaines mises en culture, dans un objectif thérapeutique.
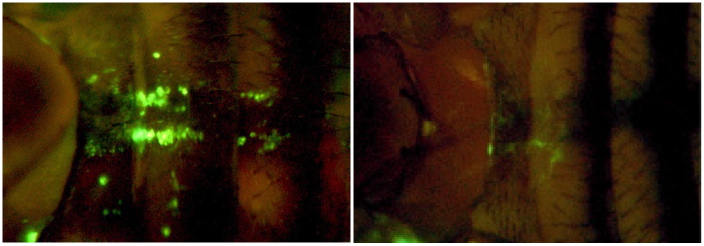
Des bactéries fluorescentes injectées dans des mouches vivantes sont immédiatement internalisées par les macrophages situés en position dorsale dans l’abdomen (phagocytose) chez les mouches contrôles (à gauche). L’expression d’une toxine bactérienne (la toxine ExoS de
Pseudomonas aeruginosa) dans ces cellules inhibe la phagocytose des bactéries.
Lors d’une infection, les cellules phagocytaires sécrètent un arsenal de protéases et de cytokines pro-inflammatoires qui contribuent à digérer la matrice extracellulaire et leur permettent d’atteindre les tissus infectés. L’emballement de la réponse immunitaire, ou sa dérégulation dans certaines pathologies inflammatoires, peut conduire à l’apparition de cancers. En effet, les signaux de la réponse immunitaire innée mettent en jeu des mécanismes de survie et de prolifération cellulaire impliqués dans l’oncogenèse et l’on observe que certains cancers sont liés à un état inflammatoire chronique
[5]. L’équipe de MO Fauvarque a utilisé des approches de génomique fonctionnelle pour l'identification de nouveaux régulateurs de signaux intracellulaires impliqués dans l'inflammation, la survie cellulaire et l'oncogenèse chez les mammifères : les voies dépendantes des facteurs NF-κB (Nuclear Factor-kappaB). Ces régulateurs appartiennent à une famille d’enzymes (les déubiquitinases) qui pourraient constituer des cibles thérapeutiques dans les domaines de l’infectiologie et du cancer. C’est le cas de la protéine USP36 dont l’expression est régulée par des signaux inflammatoires chez la souris et semble associée à des cancers de l’ovaire chez l’Homme. Au laboratoire, les fonctions de cette famille, composée d’une vingtaine d’enzymes, sont étudiées à l’échelle de l’organisme, dans des drosophiles transgéniques, et sur des modèles de cellules humaines mises en culture.
Les chercheurs de cette équipe associent les études génétiques chez la drosophile aux études de biologie cellulaire. Leur objectif est d’apporter de nouvelles connaissances sur la biologie des cellules phagocytaires et la régulation des signaux de la réponse immunitaire innée également impliqués dans la survie cellulaire et l’oncogenèse.