La formation de biofilms bactériens résulte de l’intégration de signaux émanant de l’environnement par les bactéries qui acquièrent la capacité de s’agglomérer pour former une communauté sessile, protégée de l’extérieur par la sécrétion de macromolécules biologiques, typiquement : des exopolysaccharides, des protéines d’adhésion et de l’ADN extracellulaire. Ces biofilms posent des problèmes de santé publique dès lors qu’on les retrouve sur des instruments médicaux (implants, cathéters, sondes,…) ou qu’ils permettent à la bactérie d’échapper aux défenses immunitaires de l’hôte et aux traitements antibiotiques. Ils constituent également un réservoir de bactéries favorisant l’apparition de mutants plus virulents ou résistants aux antibiotiques.
La bactérie
Pseudomonas aeruginosa présente une capacité singulière de transition entre un mode de vie « planctonique » (mobile et virulent) et un mode « biofilm » (sessile et moins virulent). Très sensible à la phagocytose des polynucléaires neutrophiles, elle n’est pas pathogène pour les individus sains, mais peut causer des infections mortelles chez les patients présentant un déficit de l’immunité cellulaire (personnes traitées par une chimio-thérapie, en réanimation ou greffées,…).
P. aeruginosa est également une des premières causes d’infections broncho-pulmonaires chez les patients atteints de mucoviscidose.
La compréhension des mécanismes de régulation bactériens contrôlant la formation de biofilms peut ouvrir la voie vers de nouvelles approches thérapeutiques. À l’heure actuelle, l’essentiel de la recherche sur les biofilms bactériens se fait
in vitro et fait donc abstraction de la réponse immunitaire de l’hôte. Des chercheurs de notre laboratoire ont utilisé la mouche du vinaigre,
Drosophila melanogaster, qui possède une immunité cellulaire efficace, pour mimer des infections chroniques à
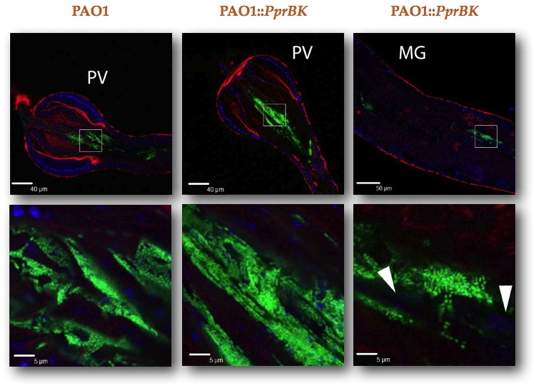
P. aeruginosa. Dans ce modèle, les mouches sont infectées par voie orale avec de la nourriture contaminée. La virulence des bactéries est mesurée par leur capacité à tuer les mouches infectées tandis que leur capacité à coloniser le tractus intestinal est observée par microscopie confocale (Figure). La souche de laboratoire
Pseudomonas PAO1 est ainsi capable de tuer les drosophiles en moins d’une semaine ; elle est retrouvée sous forme de micro-colonies extrêmement denses, caractéristiques de biofilms, dans les zones antérieures du tractus intestinal : gésier, et proventricule (Figure). Ce système a été utilisé dans le cadre d’une étude extensive d’une souche
Pseudomonas PAO1::PprBK menée par l’équipe du Dr Sophie de Bentzmann de l’Université Aix-Marseille.
In vitro, cette souche forme très facilement des biofilms. En cohérence avec les observations faites
in vitro, cette souche présente une capacité accrue à former des biofilms chez la mouche ; ainsi se maintient-elle non seulement dans la zone antérieure du tractus intestinal, mais également dans l’intestin moyen où la formation de biofilms est mise en évidence par la détection d’ADN extracellulaire autour des micro-colonies (Figure). Chez la mouche,
Pseudomonas PAO1::PprBK se révèle moins virulente que la souche parentale : un phénotype lié d’une part à une capacité réduite de traverser la barrière épithéliale intestinale, et donc de disséminer dans l’hémolymphe, et d’autre part, à l’absence de sécrétion de
toxines de système de sécrétion de type III.
Ces résultats serviront de fondement pour lancer de nouvelles recherches visant à identifier les facteurs microbiens contrôlant les infections chroniques ou aiguës dues à
P. aeruginosa ainsi que les facteurs génétiques ou physiologiques qui, chez l’hôte, interfèrent avec la formation de biofilms ou la dissémination des bactéries.
Toxines de type III : certaines bactéries fabriquent des toxines qu’elles injectent directement dans le cytoplasme d’une cellule cible par le biais d'une nano-machinerie en forme d'aiguille (système de sécrétion de type III).
Pseudomonas aeruginosa est l’une de ces bactéries.