La couche externe de la peau humaine, l’épiderme, est un tissu épithélial stratifié et squameux, qui constitue la première barrière physique et immunitaire avec notre environnement. En constant renouvellement, l’épiderme est un tissu extrêmement dynamique. Chez l’homme adulte environ 10% des kératinocytes, le principal constituant cellulaire de l’épiderme, sont renouvelés chaque jour. La maintenance de l’homéostasie épidermique dépend de la régulation fine de l’équilibre entre la prolifération des kératinocytes et leur différentiation, qui dans sa phase terminale, conduit irrémédiablement à la mort des cellules et à leur desquamation. Les mécanismes moléculaires qui contrôlent ces processus ne sont pas encore complètement élucidés. La protéine p63, un facteur de transcription de la famille p53, agit comme régulateur clé de la balance entre prolifération et différenciation des cellules épithéliales en général et des kératinocytes en particulier. Malgré les connaissances acquises sur p63 ces dernières années, les acteurs moléculaires agissant en aval de p63 pour contrôler l’homéostasie épidermique restent à découvrir. L’analyse des modifications transcriptionnelles et phénotypiques induites par l’extinction de p63 dans les kératinocytes humains normaux et matures (cultures primaires), a permis aux chercheurs du laboratoire d’identifier les réseaux de gènes (
Figure 1) agissant en aval de cette protéine pour le contrôle de l’
homéostasie épidermique. Ils ont ainsi montré que p63 est impliqué dans le maintien de la prolifération cellulaire et l’initiation de la différenciation des kératinocytes par deux mécanismes distincts.
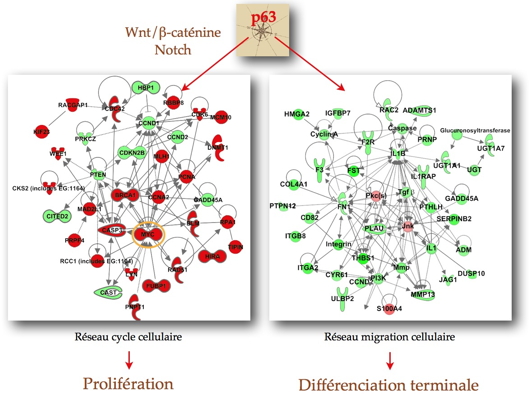
Figure 1 : La protéine p63, un facteur de transcription de la famille p53, régule la balance entre prolifération et différenciation des cellules épidermiques via les réseaux génétiques représentés sur la figure. Les gènes en rouge sont induits, ceux en vert sont réprimés. Les niveaux d’expression représentés sur la figure correspondent plutôt à des kératinocytes en prolifération de la couche basale de l’épiderme.
Le facteur de transcription p63 régule l’expression de
MYCvia les
voies de signalisation Wnt/ß-caténine et
Notch et induit un réseau génétique centré autour de MYC qui active la prolifération des kératinocytes. En revanche, la différentiation des kératinocytes est sous le contrôle direct de p63
via un réseau génétique que ces chercheurs ont caractérisé et baptisé KCF (Keratinocyte Cell Fate). Ce réseau contient des protéines impliquées dans la migration et l’adhésion cellulaires, telles que la fibronectine, l’interleukine 1 ß, la cysteine-rich protein 61 et jagged-1 qui semblent essentielles pour promouvoir la différenciation des kératinocytes.
Ce travail permet l’émergence d’une vision générale des « effecteurs » qui agissent en aval de p63 pour réguler la prolifération ou enclencher la différenciation terminale des kératinocytes. Les variations d’expression entre ces deux réseaux génétiques et leur équilibre contrôlent
in fine le destin des cellules de la peau et le maintien de l’homéostasie du tissu épidermique.
Homéostasie épidermique : Caractérise l’ensemble des fonctions de régulation de l’épiderme qui lui confèrent la capacité de maintenir un équilibre physiologique et un bon fonctionnement.
Myc est un proto-oncogène (gène dont l'expression favorise la survenue de cancers.) sur-exprimé dans certains cancers humains.
Voies de signalisation Wnt et
Notch. Le gène wingless a été identifié en premier lieu en tant que gène impliqué dans la morphogenèse chez
Drosophila melanogaster. Son dérèglement peut conduire à des cancers. La mutation Notch identifiée chez la drosophile fut l’une des premières mutations à mettre en évidence l’importance de certains gènes dans le développement embryonnaire.