La transduction de signaux intracellulaires repose sur l’organisation de réseaux moléculaires dans lesquels les protéine-kinases jouent un rôle essentiel. La perturbation de ces voies de transduction conduit invariablement à de nombreuses pathologies incluant le cancer. Les protéine-kinases représentent donc des cibles thérapeutiques majeures dans le cadre du développement de nouvelles thérapeutiques. La protéine-kinase CK2 représente le prototype d’une enzyme multi-fonctionnelle qui intervient dans le contrôle de la prolifération, de la survie et de l’intégrité cellulaire. La dérégulation de son expression dans de nombreux cancers en fait un marqueur péjoratif dans les cancers du poumon, de la prostate et les leucémies myéloïdes aiguës. Dans ce contexte, la recherche et le développement d’inhibiteurs pharmacologiques de CK2 fait l’objet d’une intense activité.
Comme c’est le cas pour l’immense majorité des inhibiteurs de protéine-kinases, les premiers inhibiteurs de CK2 décrits sont des molécules qui entrent en compétition avec la fixation de l’ATP au niveau du site catalytique de l’enzyme. Ce mécanisme d’action a pour conséquence un manque de spécificité par rapport aux autres protéine-kinases, et d’efficacité en raison de la concentration élevée de l’ATP intracellulaire.
Un criblage à haut débit d’une chimiothèque du NCI effectué en collaboration avec le centre de
Criblage pour Molécules Bio-Actives de notre laboratoire nous a permis d’identifier de nouveaux inhibiteurs de CK2 appartenant à la famille des polyoxométalates (POM). Ces composés inorganiques sont des polymères de métaux de transition (vanadate, molybdate, tungstène) et d’atomes d’oxygène.
Une étude menée en collaboration avec le groupe de Bernold Hasenknopf (Université Pierre et Marie Curie), nous a permis d’établir les principales caractéristiques de l’interaction CK2-POM.
Ces molécules se révèlent être des inhibiteurs spécifiques extrêmement puissants (IC50= 3 nM) qui bloquent l’activité catalytique de CK2 par un mécanisme non compétitif pour ses substrats (ATP et substrat protéique). Un site potentiel de fixation des POMs sur CK2 a été identifié en position distale par rapport au site catalytique de CK2 et contenant des éléments structuraux importants comme le segment d’activation.
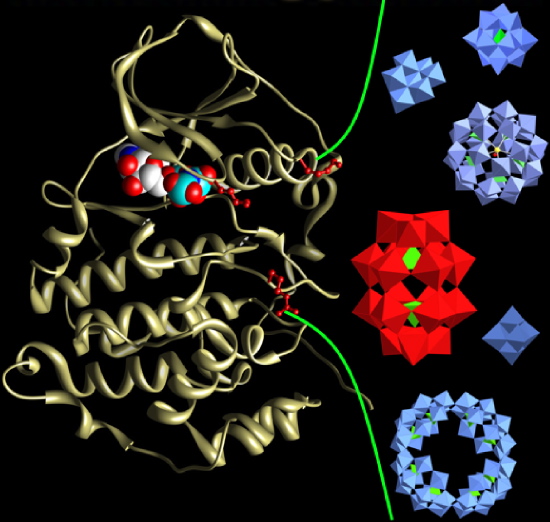
Ciblage d’une protéine kinase par des Polyoxométalates
La mise en évidence de cet « exosite » régulateur ouvre de nouvelles perspectives pour le développement d‘inhibiteurs dont le mécanisme d’action unique devrait être exploitable dans le cadre de nouveaux protocoles thérapeutiques.