Le chloroplaste est considéré comme une usine biochimique qui réalise, en plus de la photosynthèse, de très nombreuses synthèses (acides gras, acides aminés…) essentielles au développement des plantes. Ainsi, une meilleure connaissance des processus qui contrôlent la biogenèse et le métabolisme de cet organite est indispensable dans la perspective d’une meilleure valorisation de la biomasse végétale (chimie verte et bioénergie). Les modifications post-traductionnelles font partie intégrante de ces mécanismes de contrôle. La méthylation des protéines est une modification très répandue dont le rôle est encore largement incompris. Dans les chloroplastes de plantes comme le pois, le soja ou la tomate, la Rubisco, enzyme clé de la photosynthèse qui fixe le CO
2 atmosphérique, est modifiée par méthylation d’un résidu lysine. Cette modification, dont le rôle demeure inconnu, n’est pas conservée chez les céréales. Or l’enzyme qui méthyle la Rubisco, la LSMT (
large subunit Rubisco methyltransferase), est présente dans les chloroplastes de toutes les plantes ; cette enzyme s'avère donc présenter une spécificité de substrat différente suivant l’espèce considérée. Des chercheurs du laboratoire Physiologie Cellulaire & Végétale se sont intéressés à la méthylation des protéines dans les chloroplastes de la plante modèle
Arabidopsis thaliana. La caractérisation de la LSMT d’
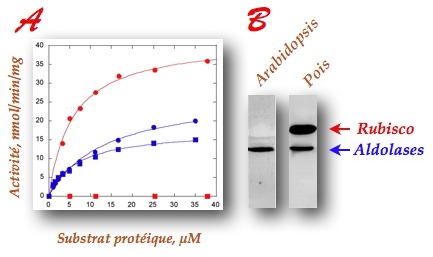
Arabidopsis par des chercheurs du laboratoire Physiologie Cellulaire & Végétale de notre institut a révélé que l’enzyme s’associe à la Rubisco sans être capable de la méthyler,
in vitro et
in vivo (
Figure). En collaboration avec l'
équipeProtéomique (EDyP) du laboratoire Biologie à Grande Échelle ils ont identifié le substrat physiologique de la méthyltransférase dans cette plante. Il s’agit des fructose 1,6-bisphosphate aldolases, enzymes impliquées dans l’assimilation du CO
2 et la glycolyse chloroplastique.
L’identification de ces nouvelles protéines chloroplastiques méthylées, chez
Arabidopsis et d’autres plantes d’intérêt agronomique (soja, colza…), suggère que le métabolisme carboné du chloroplaste puisse être régulé par méthylation. Cette découverte ouvre des perspectives importantes sur le rôle de la méthylation de la Rubisco et/ou des aldolases sur le rendement des cultures et la production de molécules à haute valeur ajoutée par les chloroplastes.
Modification post-traductionnelle : modification d'une protéine après sa synthèse par l’ajout d’un groupement chimique ou d’une petite protéine, réalisée le plus souvent par une enzyme et pouvant être réversible.